特發(fā)性肺纖維化(Idiopathic Pulmonary Fibrosis,IPF)是一種慢性����、進(jìn)行性和不可逆的肺部疾病����,其特征是肺組織逐漸被纖維化組織替代�����,導(dǎo)致肺功能下降和呼吸困難�。盡管近年來在理解IPF病理生理機(jī)制方面取得了一些進(jìn)展,但目前的治療選擇仍然非常有限����,且多局限于延緩疾病進(jìn)展��,而無法治愈����。IPF的發(fā)病機(jī)制復(fù)雜,涉及多種細(xì)胞類型和信號(hào)通路的異常變化����,包括異常的基質(zhì)沉積、慢性炎癥反應(yīng)以及肺泡上皮細(xì)胞的損傷和修復(fù)失調(diào)。
傳統(tǒng)的動(dòng)物模型����,如博萊霉素(bleomycin)誘導(dǎo)的小鼠肺纖維化模型,雖然在一定程度上能夠模擬人類IPF的病理特征�����,但由于物種間的差異����,這些模型在藥物篩選和機(jī)制研究中的轉(zhuǎn)化應(yīng)用受到限制���。因此��,開發(fā)更為精準(zhǔn)的研究工具和方法,以揭示IPF的分子和細(xì)胞機(jī)制,對(duì)于推動(dòng)新的治療策略至關(guān)重要����。
空間轉(zhuǎn)錄組學(xué)(spatial transcriptomics,SRT)是一種新興的技術(shù)�,能夠在組織的空間背景下����,分析和定位基因表達(dá)情況。這項(xiàng)技術(shù)允許研究人員在組織切片上識(shí)別不同細(xì)胞類型及其相互作用��,從而提供比單細(xì)胞RNA測(cè)序(single-cell RNA sequencing���,scRNA-seq)更全面的組織結(jié)構(gòu)和功能信息����。通過將SRT與scRNA-seq數(shù)據(jù)整合,研究人員可以更好地理解細(xì)胞在組織微環(huán)境中的分布和相互作用��。
7月1日的Nature Genetics的報(bào)道“Mapping spatially resolved transcriptomes in human and mouse pulmonary fibrosis”在該研究中�,作者利用SRT技術(shù)�����,生成了人類IPF患者和博萊霉素誘導(dǎo)的小鼠肺纖維化模型的空間轉(zhuǎn)錄組圖譜�����。通過這些圖譜�,研究揭示了IPF肺中存在的不同纖維化生態(tài)位,并詳細(xì)描述了這些生態(tài)位中細(xì)胞類型和信號(hào)通路的特征�。研究發(fā)現(xiàn)���,IPF纖維化生態(tài)位中的肺泡上皮細(xì)胞再生受阻���,而在急性纖維化小鼠模型中��,則表現(xiàn)為活躍的組織修復(fù)�。這些發(fā)現(xiàn)為IPF的發(fā)病機(jī)制提供了新的見解��,并提出了肺泡再生作為潛在治療策略的前景��。
此外,該研究還結(jié)合了單細(xì)胞RNA測(cè)序數(shù)據(jù),揭示了與IPF相關(guān)的異常細(xì)胞狀態(tài)和特定細(xì)胞群體的分布�,包括新的KRT5?/KRT17+異常基底樣(AbBa)上皮細(xì)胞群體�。這些細(xì)胞群體的發(fā)現(xiàn),進(jìn)一步豐富了我們對(duì)IPF病理生理機(jī)制的理解����,并為未來的研究和治療策略提供了新的靶點(diǎn)和方向����。通過深入分析IPF和小鼠纖維化模型中的細(xì)胞相互作用和信號(hào)傳導(dǎo)途徑�����,該研究為理解IPF提供了新的視角�����,并為未來的治療干預(yù)提供了重要依據(jù)����。

特發(fā)性肺纖維化(Idiopathic Pulmonary Fibrosis�,IPF)是一種嚴(yán)重的進(jìn)行性肺部疾病,特征是肺組織的纖維化�����,導(dǎo)致呼吸困難和肺功能衰竭���。IPF 的病因尚不完全明確����,目前的治療方法有限且效果不佳�����。為了深入理解IPF的發(fā)病機(jī)制,該研究利用空間轉(zhuǎn)錄組學(xué)(Spatial Transcriptomics���,SRT)技術(shù)和單細(xì)胞RNA測(cè)序(Single-cell RNA Sequencing,scRNA-seq)技術(shù)�����,繪制了人類和小鼠肺纖維化模型的基因表達(dá)圖譜����,從而揭示了纖維化生態(tài)位及其相關(guān)細(xì)胞類型和信號(hào)通路的特征。
研究使用了從IPF患者和健康對(duì)照(Healthy Controls�����,HCs)獲取的肺組織樣本�����,以及博萊霉素(Bleomycin��,BLM)誘導(dǎo)的小鼠肺纖維化模型����。通過對(duì)這些樣本進(jìn)行空間轉(zhuǎn)錄組學(xué)分析�,研究團(tuán)隊(duì)構(gòu)建了詳細(xì)的基因表達(dá)圖譜�����,揭示了IPF患者和小鼠模型中纖維化區(qū)域的特征�����。
人類IPF肺組織樣本來自于接受肺移植手術(shù)的患者��,而健康肺組織樣本則來自無已知肺部疾病的捐贈(zèng)者�����。每位IPF患者提供了三塊不同程度纖維化的組織樣本(分別表示輕度����、中度和重度纖維化區(qū)域)�����。這些組織樣本經(jīng)過新鮮冷凍處理����,并使用Visium空間基因表達(dá)平臺(tái)進(jìn)行分析。為了保證數(shù)據(jù)的準(zhǔn)確性和完整性���,每個(gè)樣本產(chǎn)生了255-444百萬條測(cè)序讀數(shù)����,平均每個(gè)樣本約349百萬條測(cè)序讀數(shù)。
研究中每個(gè)樣本分析的組織切片平均有約4000個(gè)捕獲點(diǎn)(capture spots)�,每個(gè)捕獲點(diǎn)代表組織中一群細(xì)胞的轉(zhuǎn)錄組,平均每個(gè)捕獲點(diǎn)檢測(cè)到超過1500個(gè)獨(dú)特基因�����。
小鼠實(shí)驗(yàn)使用了8周齡的C57BL/6NCrl雌性小鼠��,這些小鼠經(jīng)過5天的適應(yīng)期后,通過口咽途徑給予博萊霉素或生理鹽水�。實(shí)驗(yàn)在給予博萊霉素后第7天和第21天分別收集肺組織樣本,并進(jìn)行后續(xù)的空間轉(zhuǎn)錄組學(xué)和RNA測(cè)序分析���。每個(gè)小鼠樣本產(chǎn)生了151-571百萬條測(cè)序讀數(shù)����,平均每個(gè)樣本約325百萬條測(cè)序讀數(shù)���。
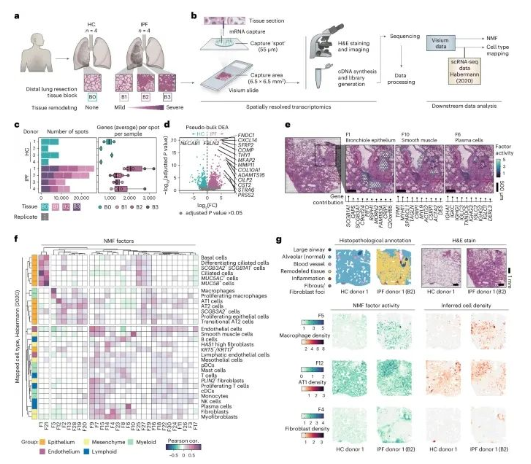
人肺纖維化的空間轉(zhuǎn)錄組學(xué)分析(Credit: Nature Genetics)
研究設(shè)計(jì)和樣本選擇:來自健康對(duì)照組(HCs)和特發(fā)性肺纖維化患者(IPF)的肺組織樣本切片�����,使用Visium空間基因表達(dá)技術(shù)進(jìn)行分析。每個(gè)IPF供體選擇了三個(gè)反映纖維化損傷程度不同的組織塊(B1, B2和B3)�。
數(shù)據(jù)處理流程:Visium工作流程和后續(xù)數(shù)據(jù)處理步驟。使用非負(fù)矩陣分解(NMF)方法進(jìn)行降維��,生成了30個(gè)不同的因子�。通過整合Habermann等人發(fā)表的單細(xì)胞RNA測(cè)序(scRNA-seq)數(shù)據(jù)�,推斷細(xì)胞類型分布��。
數(shù)據(jù)概述:總結(jié)了每個(gè)樣本的Visium捕獲點(diǎn)數(shù)量和每個(gè)點(diǎn)檢測(cè)到的獨(dú)特基因數(shù)量����。箱線圖顯示了數(shù)據(jù)的中位數(shù)、四分位數(shù)范圍和離群值�。
差異表達(dá)分析:健康對(duì)照組和IPF組之間的偽樣本差異表達(dá)分析(DEA)結(jié)果�,識(shí)別出了在條件之間顯著差異表達(dá)的基因。
空間分布圖:選定NMF因子的空間分布��,這些因子對(duì)應(yīng)于支氣管上皮(F1)�����、平滑肌(F10)和漿細(xì)胞(F6)的組織學(xué)和/或轉(zhuǎn)錄特征�。
因子活動(dòng)與細(xì)胞類型密度相關(guān)性:NMF因子活動(dòng)與推斷細(xì)胞類型密度之間的皮爾遜相關(guān)性熱圖����,使用Habermann等人的scRNA-seq數(shù)據(jù)進(jìn)行分析��,展示了所有樣本中所有點(diǎn)的相關(guān)性����。
病理學(xué)注釋:提供了每個(gè)健康對(duì)照組和IPF組織塊的組織切片的病理學(xué)注釋基于H&E染色的Visium切片����。通過可視化空間NMF活動(dòng)和推斷的細(xì)胞類型密度,展示了高度相關(guān)的因子-細(xì)胞對(duì)的共定位����。
通過空間轉(zhuǎn)錄組學(xué)分析����,研究團(tuán)隊(duì)生成了IPF患者和小鼠肺纖維化模型的基因表達(dá)圖譜。這些圖譜揭示了IPF肺中的不同纖維化生態(tài)位�,并詳細(xì)描述了這些生態(tài)位中細(xì)胞類型和信號(hào)通路的特征。
在IPF患者的肺組織樣本中�����,研究人員發(fā)現(xiàn)了顯著的基因表達(dá)差異�����。偽批量差異表達(dá)分析(Pseudobulk Differential Expression Analysis�,DEA)鑒定出了1469個(gè)在IPF和健康對(duì)照之間差異顯著的基因����,這些基因與成纖維細(xì)胞相關(guān),并且在先前研究中已被報(bào)道在IPF中上調(diào)��,包括FNDC1��、COL10A1和THY1等基因����。
這些差異主要集中在纖維化區(qū)域(Fibroblastic Foci��,F(xiàn)F)周圍�,且KRT5?/KRT17+異常基底樣(Aberrant Basaloid����,AbBa)上皮細(xì)胞密度較高����。這些細(xì)胞群體與纖維化活動(dòng)高度相關(guān)�����,表明其在IPF進(jìn)展中可能扮演重要角色����。在一些樣本中�,還觀察到了基質(zhì)金屬蛋白酶(Matrix Metalloproteinases)和參與IPF相關(guān)信號(hào)通路的基因(如SFRP2、WNT10A和TGFBI)的上調(diào)�。
在博萊霉素誘導(dǎo)的小鼠模型中,研究發(fā)現(xiàn)急性纖維化階段(第7天)和慢性纖維化階段(第21天)有顯著的基因表達(dá)變化����。第7天的樣本顯示出活躍的組織修復(fù)和炎癥反應(yīng)�����,而第21天的樣本則顯示出持續(xù)的纖維化和基質(zhì)重塑����。差異表達(dá)分析鑒定出第7天有3214個(gè)差異基因,第21天有3787個(gè)差異基因��。

小鼠和人類肺纖維化的比較空間分析(Credit: Nature Genetics)
研究設(shè)計(jì)和樣本選擇:小鼠博來霉素(BLM)誘導(dǎo)肺纖維化模型的研究設(shè)計(jì)���,包括在第7天(d7)和第21天(d21)分別收集博來霉素和生理鹽水處理的小鼠肺樣本。選擇這些時(shí)間點(diǎn)是為了涵蓋急性炎癥和早期纖維化階段(d7)�,以及已建立的纖維化階段(d21)���。
數(shù)據(jù)生成和分析:健康對(duì)照組和纖維化區(qū)域的差異表達(dá)基因(DEGs)分析結(jié)果��,比較了小鼠模型和人類IPF樣本中的DEGs���。結(jié)果顯示,有多達(dá)178個(gè)基因在小鼠和人類IPF纖維化區(qū)域之間重疊�,但其中有八個(gè)基因在表達(dá)方向上表現(xiàn)出相反的變化�,提示這些基因在兩種模型中的功能可能不同�����。
細(xì)胞類型解卷積和空間可視化:通過單細(xì)胞RNA測(cè)序數(shù)據(jù)對(duì)小鼠肺纖維化樣本進(jìn)行細(xì)胞類型解卷積和空間可視化的結(jié)果。顯示了在健康肺泡組織中推斷的細(xì)胞類型分布���,主要包括肺泡上皮細(xì)胞����。
細(xì)胞類型密度變化:BLM處理和生理鹽水對(duì)照組之間細(xì)胞類型密度的顯著差異�,包括解析(M2極化)巨噬細(xì)胞和Krt8+肺泡分化中間細(xì)胞(ADI細(xì)胞)��。第7天時(shí)AT2細(xì)胞數(shù)量減少����,但到第21天顯示出恢復(fù)的趨勢(shì)�。第7天時(shí)促炎巨噬細(xì)胞的涌入在第21天時(shí)恢復(fù)正常�����,確認(rèn)了急性炎癥的解決��。
動(dòng)態(tài)肺組織重塑:小鼠肺組織在BLM損傷后進(jìn)行的動(dòng)態(tài)空間細(xì)胞類型分區(qū)分析。在生理鹽水對(duì)照組肺中�����,鑒定了由支氣管上皮(A)和肺泡(B)組織組成的兩個(gè)區(qū)�,標(biāo)志著未受損的肺結(jié)構(gòu)��。在第7天BLM處理的小鼠肺中��,識(shí)別出由支氣管上皮(C)���、肺泡上皮和肺泡毛細(xì)血管內(nèi)皮(D)、以及由成纖維細(xì)胞和肌成纖維細(xì)胞標(biāo)記的重塑肺泡組織(E)組成的突出細(xì)胞密度區(qū)域����。到第21天�����,這些區(qū)的細(xì)胞組成發(fā)生了變化�����,除了支氣管上皮(F)和纖維化重塑的肺泡組織(G)外,還包括充滿炎癥細(xì)胞和結(jié)構(gòu)重塑的區(qū)域���。
纖維化小鼠肺中細(xì)胞類型的動(dòng)態(tài)變化:小鼠肺組織中不同時(shí)間點(diǎn)(d7和d21)的細(xì)胞類型的動(dòng)態(tài)變化。主要展示了肺泡上皮細(xì)胞�����、成纖維細(xì)胞���、巨噬細(xì)胞和肌成纖維細(xì)胞的分布和數(shù)量變化���。結(jié)果顯示���,在d7時(shí),小鼠肺組織中成纖維細(xì)胞和促炎巨噬細(xì)胞顯著增加��,表明急性炎癥反應(yīng)����。在d21時(shí)����,成纖維細(xì)胞和巨噬細(xì)胞的數(shù)量有所減少��,但仍高于對(duì)照組�����,表明纖維化進(jìn)程仍在進(jìn)行����。
空間轉(zhuǎn)錄組學(xué)揭示的基因表達(dá)變化:小鼠肺纖維化過程中不同時(shí)間點(diǎn)的特定基因表達(dá)變化���。主要展示了與細(xì)胞外基質(zhì)(ECM)重塑���、炎癥和纖維化相關(guān)的基因表達(dá)水平�����。結(jié)果顯示���,在d7時(shí),MMP12、POSTN和COL1A1等基因的表達(dá)顯著增加�,這些基因與ECM重塑和纖維化密切相關(guān)。到d21時(shí)���,這些基因的表達(dá)水平有所下降��,但仍高于對(duì)照組,表明纖維化過程中的基因表達(dá)動(dòng)態(tài)變化�����。
人IPF和小鼠模型之間的比較分析:人IPF樣本和小鼠BLM模型之間在特定基因表達(dá)和細(xì)胞類型分布上的比較分析��。主要展示了兩者在基因表達(dá)模式和細(xì)胞類型上的相似性和差異�。結(jié)果顯示���,一些關(guān)鍵基因如COL1A1和FN1在IPF和小鼠纖維化區(qū)域中都顯著上調(diào),表明這些基因在纖維化過程中的重要作用�����。同時(shí)����,一些基因在兩者之間的表達(dá)模式有所不同,提示人類IPF和小鼠模型在纖維化機(jī)制上存在一定的差異����。
研究還通過單細(xì)胞RNA測(cè)序數(shù)據(jù)��,揭示了與IPF相關(guān)的細(xì)胞狀態(tài)���,包括異常的上皮細(xì)胞����、成纖維細(xì)胞和促纖維化肺泡巨噬細(xì)胞��。還鑒定出一種新的KRT5?/KRT17+異?���;讟由掀ぜ?xì)胞群體�����,這些細(xì)胞表達(dá)上皮��、基底和間充質(zhì)標(biāo)志物以及與衰老和細(xì)胞外基質(zhì)(Extracellular Matrix����,ECM)產(chǎn)生相關(guān)的基因。盡管這些細(xì)胞可能源自肺泡II型細(xì)胞(Alveolar Type 2����,AT2)或Clara細(xì)胞��,但它們?cè)诶w維化微環(huán)境中的角色仍不清楚。
在研究中發(fā)現(xiàn),IPF肺纖維化生態(tài)位中�,轉(zhuǎn)化生長(zhǎng)因子β(Transforming Growth Factor Beta,TGF-β)信號(hào)通路占主導(dǎo)地位,并伴有TP53和APOE等預(yù)測(cè)調(diào)控因子。同時(shí)���,還觀察到肺泡上皮細(xì)胞的再生受阻,與急性纖維化小鼠模型中的活躍組織修復(fù)形成鮮明對(duì)比�����。
該研究通過空間轉(zhuǎn)錄組學(xué)和單細(xì)胞RNA測(cè)序技術(shù),詳細(xì)描繪了IPF和小鼠肺纖維化模型中的細(xì)胞相互作用和信號(hào)傳導(dǎo)途徑�����,揭示了關(guān)鍵的趨同和分歧路徑。這些發(fā)現(xiàn)為我們提供了對(duì)IPF細(xì)胞相互作用的深入理解�����,并提出了肺泡再生作為IPF潛在治療策略的前景�。未來的研究可進(jìn)一步探討KRT5?/KRT17+異?�;讟由掀ぜ?xì)胞在IPF中的具體功能及其調(diào)控機(jī)制��。此外�����,研究還可關(guān)注不同纖維化階段的細(xì)胞相互作用和信號(hào)傳導(dǎo)變化�,以期為IPF的治療提供新的靶點(diǎn)和策略���。




 17312606166
17312606166