近日,創(chuàng)新型人工血管領(lǐng)軍者Xeltis宣布���,其用于冠狀動(dòng)脈旁路移植術(shù)(CABG)的小口徑人工血管Xabg的初步臨床數(shù)據(jù)令人鼓舞����。
Xabg在患有多支冠脈血管病變的患者體內(nèi)植入24個(gè)月后����,顯示出良好的安全性和通暢性,創(chuàng)下了用于冠脈搭橋的人工血管在體內(nèi)長(zhǎng)期保持通暢和功能完整的首次記錄�����。

如今�,Xeltis�����、Humacyte和Medical 21等新型人工血管公司都在快速推進(jìn)冠脈搭橋人工血管的上市進(jìn)程���。
Humacyte計(jì)劃在2025年向美國(guó)食品藥品監(jiān)督管理局(FDA)提交研究性新藥(IND)申請(qǐng),以支持其ATEV?(組織工程小口徑人工血管�,用于CABG)的首次人體臨床研究。但由于Humacyte的產(chǎn)品屬于生物制品��,因此其上市進(jìn)程可能會(huì)晚于Xabg和Medical 21的產(chǎn)品�。
因此目前看來,Xeltis的Xabg是最有希望首款上市的冠脈搭橋人工血管�����。
Xabg目前已完成臨床入組���,并已有患者完成2年隨訪并顯示出了積極結(jié)果����,這不僅讓Xeltis信心大增�,也讓其它參與者也看到人工血管作為CABG血管橋的希望。
Xeltis首席醫(yī)學(xué)官Paulo Neves評(píng)論道:“盡管表現(xiàn)并不理想�����,但80%的CABG手術(shù)仍依賴靜脈移植——Xeltis有潛力徹底改變這一現(xiàn)狀�。令人鼓舞的安全性和通暢性數(shù)據(jù)是Xeltis的一個(gè)重要里程碑����,證明了Xabg有潛力顯著改善冠心病患者的治療結(jié)果����。我們感謝參與試驗(yàn)的所有人��,并期待繼續(xù)招募患者并進(jìn)行治療��?�!?/p>
哥倫比亞大學(xué)醫(yī)學(xué)中心外科主任Isaac George補(bǔ)充道:“Xeltis正在推動(dòng)血管通路解決方案領(lǐng)域的創(chuàng)新邊界��。最近的24個(gè)月隨訪數(shù)據(jù)令人驚嘆����,這是首次在24個(gè)月時(shí)保持開放并展示出色血流的案例���。結(jié)合在歐洲的安全性和通暢性結(jié)果��,這進(jìn)一步證明了Xabg具有改善長(zhǎng)期治療結(jié)果�����、減少再次干預(yù)需求以及顯著影響患者護(hù)理和醫(yī)療成本的潛力���?!?/p>
# 研究背景
心血管疾病是全球死亡的首要原因,而冠狀動(dòng)脈旁路移植術(shù)(CABG)是全球最常見的心臟外科手術(shù)�����。
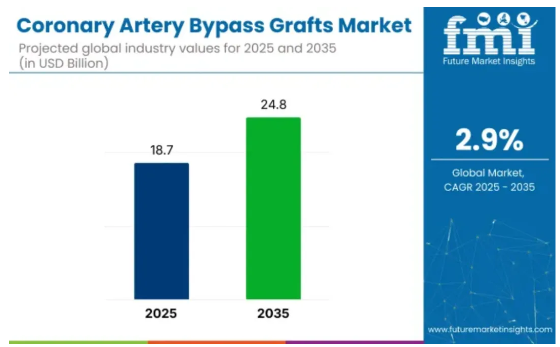
據(jù)Future Market Insights預(yù)測(cè)�����,預(yù)計(jì)到2035年���,全球CABG市場(chǎng)規(guī)模將超過200億美元�����,這一增長(zhǎng)主要受到心血管疾病患病率上升的推動(dòng)�����。
當(dāng)冠狀動(dòng)脈發(fā)生嚴(yán)重病變�,常需要血管移植物來恢復(fù)心臟的血流供應(yīng)和功能����,因此小口徑人工血管(內(nèi)徑≤6mm)在CABG中發(fā)揮著至關(guān)重要的作用。
傳統(tǒng)高分子小口徑人工血管如膨體聚四氟乙烯(ePTFE)已在臨床使用近50年�,主要由戈?duì)枴偷?�、邁柯唯等海外企業(yè)壟斷��。然而ePTFE小口徑人工血管存在兩大缺陷:易形成血栓造成通暢率低和感染發(fā)生率高���,嚴(yán)重影響臨床效果�,限制了其廣泛使用�,這導(dǎo)致臨床醫(yī)生和患者“想用又不敢用,有需求卻缺選擇”���。
當(dāng)前臨床高度依賴患者自身靜脈作為移植物,但這不僅增加了手術(shù)創(chuàng)傷�,還受限于患者靜脈質(zhì)量和數(shù)量。
隨著材料科學(xué)和再生醫(yī)學(xué)的進(jìn)步����,一種能夠在體內(nèi)自然形成活體血管、且長(zhǎng)期保持通暢的新型人工血管���,正成為解決小口徑血管替代難題的突破口�����。
在這一背景下��,基于生物修復(fù)理念的新型人工血管正在臨床中展現(xiàn)出令人鼓舞的前景。
Xabg是一款用于CABG的新型生物修復(fù)性人工血管���,其采用超分子化學(xué)技術(shù)�����,通過靜電紡絲技術(shù)制備成納米纖維�,并內(nèi)嵌有鎳鈦合金支架�����,合成新型的超分子聚合物����。
Xabg的直徑為4mm,壁厚500μm����,長(zhǎng)度為12cm,采用多孔的設(shè)計(jì)���,植入瞬間便能夠被血細(xì)胞滲透����,且具備一定的機(jī)械支撐�,可立刻充當(dāng)功能性血液流通管道。隨著時(shí)間的流逝���,Xabg會(huì)逐漸發(fā)生重塑�,實(shí)現(xiàn)內(nèi)皮化進(jìn)程�����。
該產(chǎn)品基于Xeltis專有的內(nèi)源性組織修復(fù)(ETR)平臺(tái)開發(fā)����,ETR平臺(tái)采用了獲得諾獎(jiǎng)的聚合物技術(shù)�����,使得Xabg具有獨(dú)特的再生特性,能夠隨著時(shí)間的推移逐漸重塑為患者自體血管�����。
# 相關(guān)臨床研究
Xabg是Xeltis第2款進(jìn)入臨床開發(fā)的產(chǎn)品����,此前該公司已推出aXess(一種用于透析的修復(fù)性血管通路),目前其關(guān)鍵性試驗(yàn)正在歐盟和美國(guó)進(jìn)行��,這展示了該公司在邁向商業(yè)化過程中強(qiáng)大的臨床產(chǎn)品線�����。
動(dòng)物試驗(yàn)
Xabg已完成臨床前動(dòng)物試驗(yàn),動(dòng)物模型為綿羊����。
1年動(dòng)物試驗(yàn)數(shù)據(jù)顯示Xabg植入后具有前所未有的通暢性,術(shù)后1年無(wú)血管狹窄��、閉塞�����。Xabg植入后,逐漸通過動(dòng)物自身的組織來替代聚合物血管�����。由于均質(zhì)的內(nèi)皮化過程�����,整根Xabg的內(nèi)表面顯示出光滑且融合或充滿的內(nèi)皮細(xì)胞襯里����。內(nèi)皮化是血管愈合的最后階段����,能夠有效防止血栓形成和其他不良結(jié)局。
臨床試驗(yàn)
Xeltis正在進(jìn)行一項(xiàng)前瞻性����、單臂、非隨機(jī)FIH可行性研究���,旨在評(píng)估Xabg在多支動(dòng)脈粥樣硬化性冠狀動(dòng)脈疾病患者中的初步安全性和性能���,由當(dāng)?shù)匦呐K團(tuán)隊(duì)安排接受擇期CABG。
目前該臨床試驗(yàn)已取得初步積極數(shù)據(jù),顯示Xabg在患者體內(nèi)功能良好��,血流通暢����。
Xabg在一位患者接受CABG后的24個(gè)月隨訪中顯示出良好的通暢性和出色的血液相容性�����,是冠脈搭橋人工血管首次在人體內(nèi)保持通暢和完整功能性如此之久���。這一臨床案例進(jìn)一步驗(yàn)證了Xeltis的ETR科學(xué)技術(shù)的有效性���,重新定義了血管移植物和解決方案的格局�����。
# 中國(guó)人工血管市場(chǎng)概況
根據(jù)《全球及中國(guó)人工血管行業(yè)研究及十四五規(guī)劃分析報(bào)告》�,2020年全球人工血管市場(chǎng)規(guī)模達(dá)到235億元,預(yù)計(jì)2027年將達(dá)到318億元�。如今,國(guó)內(nèi)臨床上應(yīng)用的主要為大���、中口徑人工血管���,仍未有小口徑人工血管獲批����。目前���,我國(guó)的進(jìn)口人工血管售價(jià)在1~4萬(wàn)元之間��。2020年�,國(guó)內(nèi)人工血管市場(chǎng)規(guī)模逾30億元人民幣(按終端價(jià)計(jì))���。整體來說�,未來主動(dòng)脈置換和血液透析動(dòng)靜脈造瘺將占據(jù)人工血管主要的市場(chǎng)份額�����。預(yù)計(jì)人工血管市場(chǎng)在未來三至五年將保持超過15%的市場(chǎng)增速�����,到2025年整體國(guó)內(nèi)市場(chǎng)規(guī)?����;蚪咏?0億元人民幣。
人工血管作為冠狀動(dòng)脈搭橋手術(shù)和動(dòng)靜脈瘺管的有效替代材料�����,在心血管疾病治療中具有重要作用����,這一市場(chǎng)仍處于藍(lán)海階段����。雖然大、中口徑人工血管已廣泛應(yīng)用于臨床���,但其再狹窄發(fā)生率高���。小口徑人工血管在冠狀動(dòng)脈旁路移植術(shù)��、外周血管旁路移植術(shù)���、血管創(chuàng)傷(缺損≥2cm)�、血液透析血管通路等臨床應(yīng)用中具有重要地位,市場(chǎng)近年來發(fā)展迅速��,其應(yīng)用領(lǐng)域廣泛且市場(chǎng)需求持續(xù)增長(zhǎng)�。
作為長(zhǎng)期植入人體的人工器官��,小口徑人工血管對(duì)性能的要求極為嚴(yán)苛�,制造工藝復(fù)雜、周期長(zhǎng)�����、投入大���,且技術(shù)壁壘較高����。這一過程涉及材料工程���、生物工程�、醫(yī)學(xué)和紡織工程等多個(gè)學(xué)科的專業(yè)技術(shù)���。
國(guó)內(nèi)外有多家公司在小口徑人工血管領(lǐng)域進(jìn)行了深入研究和開發(fā)�����,其中一些已經(jīng)取得了顯著的進(jìn)展并獲得了市場(chǎng)認(rèn)可�����。目前���,我國(guó)人工血管市場(chǎng)仍由外資品牌主導(dǎo)��,邁柯唯�、泰爾茂�、巴德醫(yī)療和戈?duì)柟镜日紦?jù)了大部分市場(chǎng)份額�����。直徑小于6毫米的小口徑人工血管在國(guó)內(nèi)尚無(wú)成功用于臨床的國(guó)產(chǎn)產(chǎn)品��。目前����,國(guó)內(nèi)僅有少數(shù)企業(yè)布局研發(fā)��,代表企業(yè)包括海邁醫(yī)療、武漢楊森�、杭州領(lǐng)博、蘇州海邁����、深圳柔脈、天津心衢����、上海生納和上海暢迪等�����。




 17312606166
17312606166