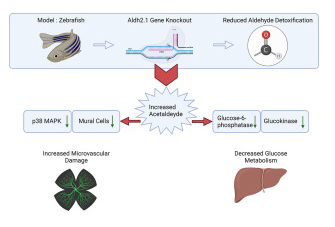
摘要:活性羰基化合物(RCS)是在新陳代謝過(guò)程中自發(fā)形成的,會(huì)改變和損害DNA、蛋白質(zhì)和脂質(zhì)的功能��,導(dǎo)致多種器官并發(fā)癥。在斑馬魚(yú)中,RCS解毒酶乙二醛酶1(Glo 1)�、醛脫氫酶3a1(Aldh3a1)和醛酮還原酶1a1a(Akr1a1a)的敲除顯示RCS升高,其特異性地調(diào)節(jié)葡萄糖代謝、高血糖和糖尿病器官損傷��。在 glo1-/- 動(dòng)物中aldh2.1 是補(bǔ)償性上調(diào)的��,因此本研究旨在研究與乙醇暴露無(wú)關(guān)情況下, Aldh2.1 在斑馬魚(yú)中對(duì) RCS 的解毒能力����。使用 CRISPR/Cas9 生成 aldh2.1 敲除斑馬魚(yú)����,隨后在組織學(xué)�����、代謝組學(xué)和轉(zhuǎn)錄組學(xué)水平上進(jìn)行分析��。 aldh2.1-/- 斑馬魚(yú)顯示內(nèi)源性乙醛 (AA)增加 ��,誘導(dǎo)視網(wǎng)膜脈管系統(tǒng)血管生成增加。表達(dá)和藥理學(xué)介入研究確定了由 AA 誘導(dǎo)的 c-Jun N-末端激酶 (JNK) 和 p38 MAPK 的失衡���,其介導(dǎo)了血管生成的激活��。此外����,aldh2.1-/- 斑馬魚(yú)中 AA 的增加不會(huì)引起高血糖����,相反,AA 會(huì)抑制葡萄糖激酶 (gck) 和葡萄糖-6-磷酸酶 (g6pc) 的表達(dá)���,從而導(dǎo)致葡萄糖代謝受損��。
關(guān)鍵詞:醛脫氫酶 (ALDH) 乙醛(AA) 活性羰基物質(zhì) (RCS) 葡萄糖代謝 微血管器官并發(fā)癥 斑馬魚(yú)
簡(jiǎn)介:活性羰基物質(zhì) (RCS) 是一類代謝物,與葡萄糖代謝受損、胰島素抵抗和微血管損傷有關(guān)��。甲基乙二醛(MG)是研究得最好的代表,其作為晚期糖基化終產(chǎn)物(AGEs)前體的毒性而聞名。由 glo1 和 glo 2 組成的乙二醛酶 (Glo) 酶系統(tǒng)利用了 MG 的解毒作用���。然而�����,最近在斑馬魚(yú)和小鼠中的研究表明����,敲除 glo1 僅導(dǎo)致內(nèi)源性 MG 增加 50%��。因此��,glo1基因敲除斑馬魚(yú)雖然表現(xiàn)出糖耐量受損�����,但并沒(méi)有出現(xiàn)器官損傷,只有在攝入高熱量后��,它們的視網(wǎng)膜血管系統(tǒng)才會(huì)發(fā)生改變�����,這與臨床糖尿病視網(wǎng)膜病變的病理結(jié)果一致�。這些結(jié)果表明,體內(nèi)glo1 MG 解毒能力的喪失可以通過(guò)其他酶系統(tǒng)得到補(bǔ)償。 事實(shí)上,glo1 突變體中醛脫氫酶 (Aldh) 和醛酮還原酶 (Akr) 的活性測(cè)量表明這兩個(gè)酶家族可以作為 MG 的替代解毒系統(tǒng)�。隨后對(duì)斑馬魚(yú)中不同 Aldh 和 Akr 亞類成員的研究��,包括 aldh3a1 和 akr1a1a 斑馬魚(yú)突變體的產(chǎn)生和分析,發(fā)現(xiàn)不是 MG,而是 Aldh3a1 的 4-羥基壬烯醛 (4-HNE) 和 Akr1a1a 的丙烯醛 (ACR) 是首選的解毒 RCS。雖然兩種突變體的葡萄糖代謝均受損�����,但 aldh3a1 突變體中 4-HNE 增加會(huì)破壞胰腺�����,導(dǎo)致高血糖和視網(wǎng)膜血管改變,而 akr1a1a 突變體中 ACR 增加會(huì)導(dǎo)致胰島素抵抗和成年動(dòng)物糖尿病視網(wǎng)膜病變和糖尿病腎病。數(shù)據(jù)已經(jīng)確定了 RCS 及其相應(yīng)解毒酶在調(diào)節(jié)葡萄糖代謝方面的特定特征,這些系統(tǒng)的改變導(dǎo)致葡萄糖耐量受損、胰島素抵抗、高血糖和微血管并發(fā)癥����。
glo1-/- 斑馬魚(yú)突變體中的 aldh2.1 表達(dá)也有所增加��。 aldh2.1 是斑馬魚(yú)與人類 aldh2 的同源物���,可以解毒多種反應(yīng)性代謝物�����,包括乙醛 (AA)�、4-HNE���、丙二醛 (MDA) 和 MG��。由于 Aldh2 將 AA 氧化為乙酸�����,因此對(duì)其在酒精代謝和酒精引起的應(yīng)激并發(fā)癥中的重要性進(jìn)行了充分研究���,發(fā)現(xiàn)在酒精性肝病和心血管疾病中起關(guān)鍵作用����。此外��,aldh2 的缺失會(huì)增加活性氧 (ROS),從而導(dǎo)致線粒體功能障礙和細(xì)胞色素 P450 2E1 (CYP2E1) 的上調(diào)�����。然而����,Aldh2對(duì)反應(yīng)性代謝物解毒��、糖代謝調(diào)節(jié)和糖尿病微血管并發(fā)癥形成的貢獻(xiàn),是否與乙醇暴露無(wú)關(guān)�,目前尚不清楚。因此����,本研究旨在評(píng)估 Aldh2.1 對(duì)斑馬魚(yú)不同 RCS 的解毒能力���,并確定 Aldh2.1 對(duì)葡萄糖代謝�、器官生理和疾病的潛在調(diào)節(jié)功能��。我們的數(shù)據(jù)確定��,斑馬魚(yú)中 aldh2.1 的缺失導(dǎo)致內(nèi)源性 AA 濃度增加���,隨后損害了斑馬魚(yú)仔魚(yú)和成魚(yú)的葡萄糖代謝并導(dǎo)致視網(wǎng)膜血管微血管損傷。
aldh2.1-/- 基因敲除斑馬魚(yú)的生成和驗(yàn)證:最近對(duì)脊椎動(dòng)物和哺乳動(dòng)物的研究表明,Aldh酶在解毒短鏈和長(zhǎng)鏈RCS中起主要作用���。為了研究 Aldh2.1 對(duì) RCS 解毒和葡萄糖代謝調(diào)節(jié)的影響��,我們創(chuàng)建了一個(gè) aldh2.1 基因敲除斑馬魚(yú)模型,因?yàn)橹暗难芯勘砻?aldh2.1 在反應(yīng)性代謝物解毒中具有補(bǔ)償功能。Aldh2.1 酶在人類����、小鼠和斑馬魚(yú)中表達(dá)。 然而�����,尚未描述不同物種之間酶氨基酸序列的相似性����。因此��,該研究的第一步是對(duì)斑馬魚(yú)和人類、斑馬魚(yú)和小鼠之間的氨基酸序列進(jìn)行比對(duì)���,發(fā)現(xiàn)斑馬魚(yú)和人類之間的相似性達(dá)到78.2%���,斑馬魚(yú)和小鼠之間的相似性達(dá)到77.4%���。整個(gè)物種的活性位點(diǎn)中的半胱氨酸和谷氨酸氨基酸被完全保留并在每個(gè)物種中保持不變��。迄今為止,還沒(méi)有產(chǎn)生 aldh2.1-/- 斑馬魚(yú)品系�,因此利用 CRISPR/Cas9 技術(shù)創(chuàng)建了 aldh2.1 基因敲除模型。首先,合成靶向 aldh2.1 外顯子 3 的 CRISPR-guideRNA (gRNA),并與 Cas9 mRNA 一起注射到單細(xì)胞期 Tg(fli1:EGPF) 斑馬魚(yú)胚胎中����。 由于五個(gè)核苷酸的缺失,測(cè)序發(fā)現(xiàn)了一個(gè)由于五個(gè)核苷酸缺失而導(dǎo)致的閱讀移碼突變,然后將其用于進(jìn)一步的育種和研究。為了驗(yàn)證純合 aldh2.1-/- 突變體的產(chǎn)生��,進(jìn)行了蛋白質(zhì)印跡并顯示肝臟中的 Aldh2.1 蛋白完全喪失����。與 aldh2.1+/+ 仔魚(yú)相比,受精后 5 天 (dpf) 的 aldh2.1-/- 仔魚(yú)的總體形態(tài)沒(méi)有改變��。在少數(shù) aldh2.1-/- 胚胎/仔魚(yú)中��,肝臟似乎變大�。 有趣的是,成年 aldh2.1-/- 動(dòng)物的存活率偏離了估計(jì)的孟德?tīng)柗植迹⑶绎@著低于預(yù)期。在 282 條成年斑馬魚(yú)中�,99 條(35.1%)為 aldh2.1+/+�,122 條(43.2%)為 aldh2.1+/-,只有 61 條(21.7%)有 Δ5 bp 型的 aldh2.1-/-��, 這些結(jié)果表明�,Aldh2.1 的永久丟失會(huì)對(duì)斑馬魚(yú)產(chǎn)生負(fù)面影響���。由于 aldh2.1 在成年斑馬魚(yú)中的表達(dá)是未知的�����,因此使用 RT-qPCR 分析來(lái)研究 aldh2.1 在整個(gè)斑馬魚(yú)器官中的表達(dá)��。與持家基因 b2m 的表達(dá)相比�����,我們發(fā)現(xiàn) aldh2.1 在肝臟 (15%) 中的表達(dá)最高����,其次是大腦 (6.8%) 和眼睛 (5%)���?����?傮w而言�,這些結(jié)果證實(shí)了 aldh2.1 在斑馬魚(yú)器官中的表達(dá)與其他脊椎動(dòng)物相當(dāng)。 接下來(lái),使用不同的 RCS 作為底物進(jìn)行了一組 Aldh 酶活性測(cè)量,以確認(rèn) aldh2.1 敲除導(dǎo)致總 Aldh 酶活性的功能性降低���。使用以下底物可以觀察到 aldh2.1-/- 仔魚(yú)裂解物中總 Aldh 酶活性顯著降低:AA (67%)����、MG (31%)��、4-HNE (23%) 和 MDA (16%) )�����。以ACR(圖1K)為底物的Aldh總酶活性也降低了28%����,但不顯著。這些結(jié)果不僅進(jìn)一步證明了 aldh2.1-/- 突變體的成功產(chǎn)生���,而且還確定了 Aldh2.1 酶在斑馬魚(yú)中對(duì)RCS 的解毒能力��。
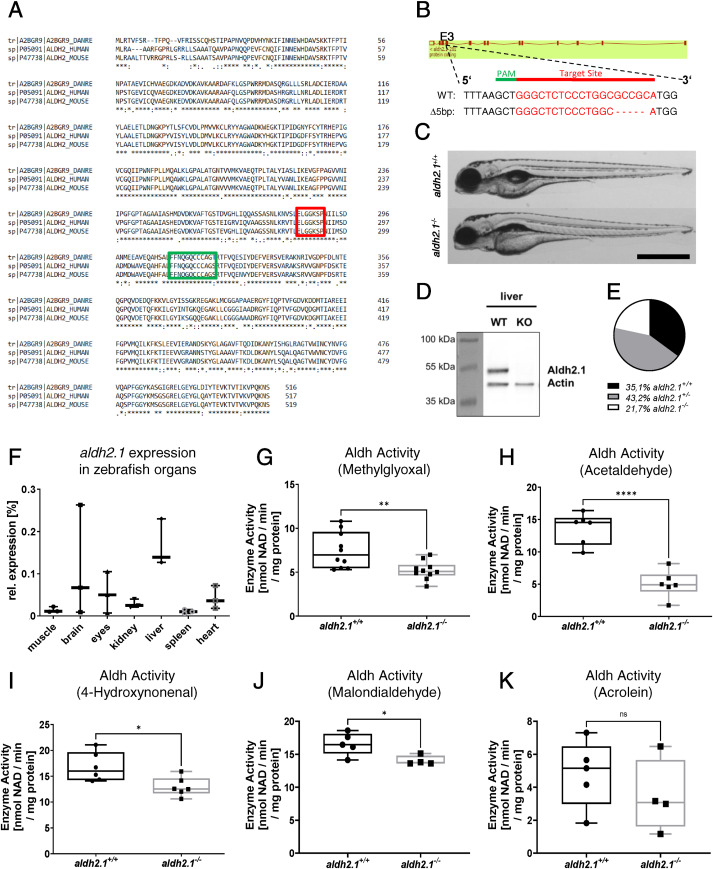
圖 1. aldh2.1-/- 斑馬魚(yú)系的生成和驗(yàn)證。
aldh2.1 的缺失導(dǎo)致斑馬魚(yú)仔魚(yú)和成魚(yú)視網(wǎng)膜血管系統(tǒng)的血管生成:在之前的研究中,可以發(fā)現(xiàn)斑馬魚(yú)眼睛中的外源性和內(nèi)源性反應(yīng)性代謝產(chǎn)物通過(guò)受損的葡萄糖代謝損害微血管�。為了研究 aldh2.1 敲除對(duì)血管發(fā)育的潛在后果,我們通過(guò)共聚焦顯微鏡分析了仔魚(yú)和成年斑馬魚(yú)的脈管系統(tǒng)。 與 5 dpf 的 aldh2.1+/+ 仔魚(yú)相比,可以確定 aldh2.1-/- 斑馬魚(yú)仔魚(yú)的玻璃體血管系統(tǒng)中的分支點(diǎn)增加���。12 mpf 時(shí)成魚(yú)視網(wǎng)膜血管系統(tǒng)的量化證實(shí)了這些結(jié)果。與 aldh2.1+/+ 成魚(yú)相比,aldh2.1-/- 成魚(yú)的視網(wǎng)膜血管高密度區(qū)域的分支點(diǎn)也增加了�����。此外,使用胰蛋白酶和隨后的 Mayer 蘇木精染色制備成魚(yú)視網(wǎng)膜的消化物顯示血管壁細(xì)胞覆蓋率損失 10%���,而 aldh2.1-/- 斑馬魚(yú)血管中的內(nèi)皮細(xì)胞數(shù)量沒(méi)有變化���。此外�����,成年 aldh2.1-/- 斑馬魚(yú)的血管比 aldh2.1+/+ 斑馬魚(yú)的血管更寬��,隨后每條血管的毛細(xì)血管面積增加了 10%�。除了眼睛�����,還分析了斑馬魚(yú)的腎臟���。 相反�����,PAS染色和電子顯微鏡都沒(méi)有發(fā)現(xiàn)明顯的變化。這些結(jié)果表明����,Aldh2.1 的功能喪失導(dǎo)致血管系統(tǒng)的改變����,與患有視網(wǎng)膜病變的患者相似�。由于鮮有報(bào)道稱活性代謝物與視網(wǎng)膜損傷之間存在關(guān)聯(lián)�����,因此對(duì)仔魚(yú)和成年斑馬魚(yú)中的幾種活性代謝物進(jìn)行了測(cè)量����。
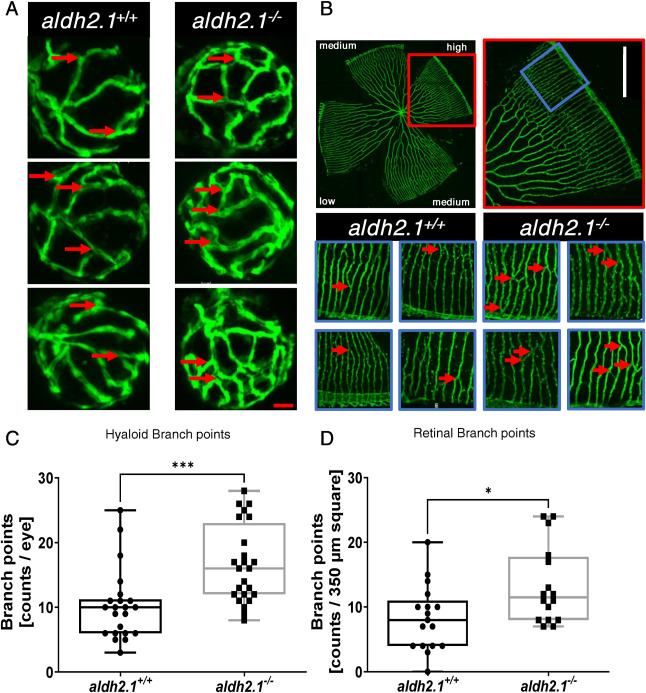
圖 2. aldh2.1 的缺失導(dǎo)致斑馬魚(yú)仔魚(yú)和成魚(yú)視網(wǎng)膜血管系統(tǒng)中的血管生成增加��。
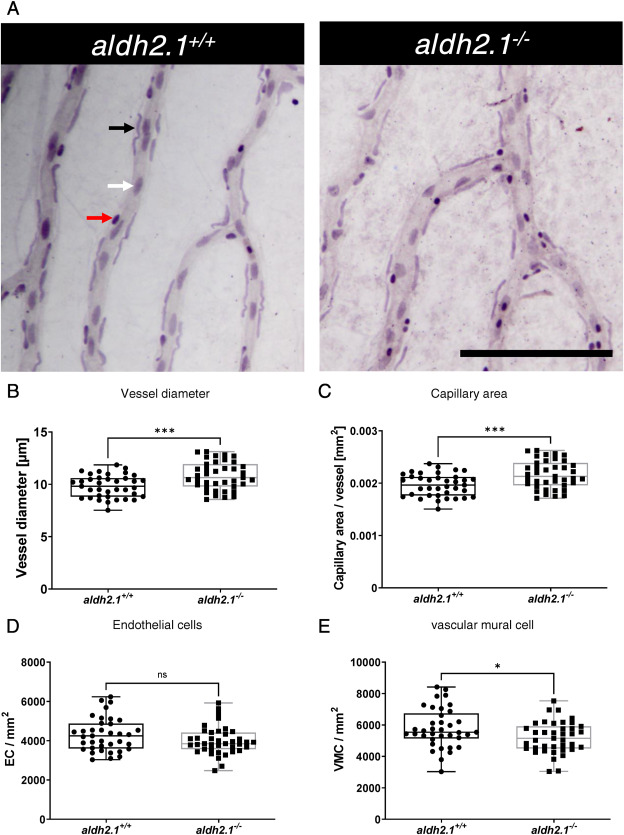
圖 3. aldh2.1-/- 視網(wǎng)膜中血管增厚和血管壁細(xì)胞覆蓋率降低���。
aldh2.1-/- 突變體顯示內(nèi)源性 AA 升高和餐后血糖降低:
之前關(guān)于Aldh3a1酶引起的糖尿病器官并發(fā)癥的研究表明�����,RCS解毒功能受損是視網(wǎng)膜新生血管增加的原因���。然而,aldh2.1-/- 突變體的解毒活性受損是否會(huì)轉(zhuǎn)化為類似的內(nèi)源性反應(yīng)性代謝物升高或葡萄糖代謝受損仍然未知�����。我們對(duì)96 hpf齡仔魚(yú)和成年斑馬魚(yú)器官中的葡萄糖和活性代謝物進(jìn)行了一系列測(cè)量����。在仔魚(yú)體內(nèi),未發(fā)現(xiàn)全身葡萄糖�����、鎂���、乙二醛����、4-HNE和ACR的變化�����。我們可以確定反應(yīng)性代謝物 AA 的升高����,與 aldh2.1+/+ 相比,aldh2.1-/- 仔魚(yú)的 AA升高 4.2 倍,但代謝組的AA保持不變。在成年斑馬魚(yú)中�,禁食 aldh2.1?/? 斑馬魚(yú)肝臟中的 AA 濃度增加了 4.3 倍����。然而���,空腹和餐后 MG 沒(méi)有變化�。有趣的是,雖然 aldh2.1-/- 成魚(yú)的空腹血糖水平?jīng)]有變化��,但餐后測(cè)量顯示血糖水平降低����?���?傊?����,數(shù)據(jù)已確定 AA 是斑馬魚(yú)中 Aldh2.1 解毒活性的主要 RCS。 盡管 aldh2.1 敲除對(duì)廣泛的 RCS 的總 Aldh 酶活性有影響�����,但只有 AA 在體內(nèi)積累����。
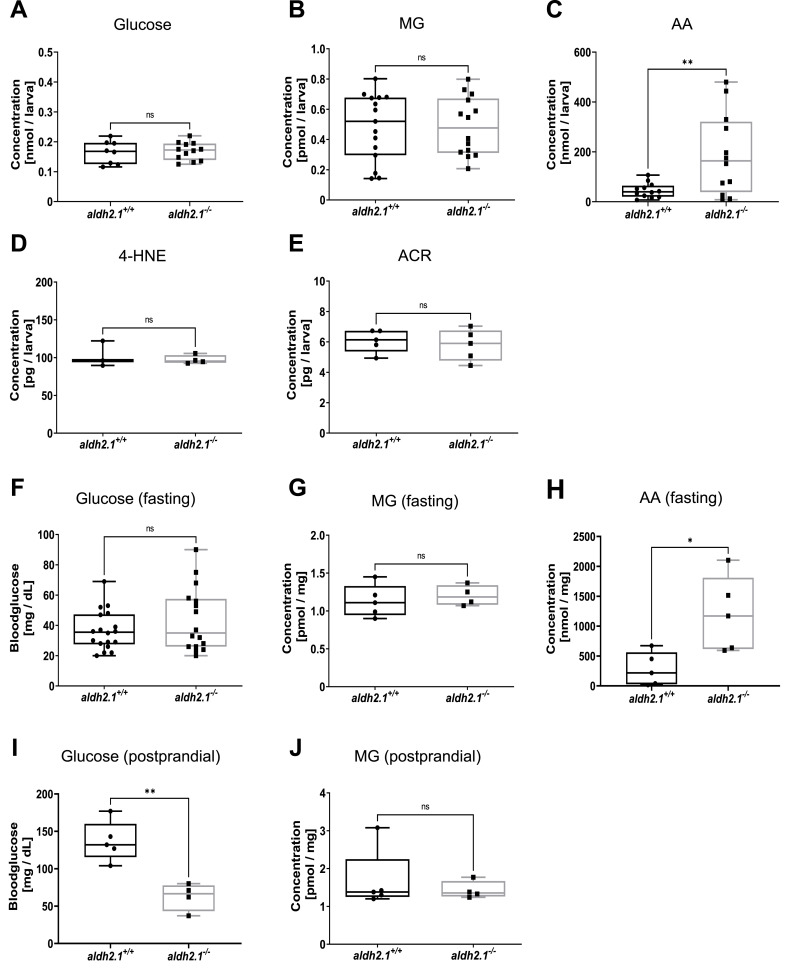
圖 4. aldh2.1-/- 突變體顯示內(nèi)源性 AA 升高和餐后血糖降低。
aldh2.1-/- 突變體表現(xiàn)出應(yīng)激信號(hào)加重和糖酵解障礙:為了研究導(dǎo)致 aldh2.1-/- 突變體血管改變的潛在機(jī)制并解決為什么 aldh2.1-/- 突變體會(huì)導(dǎo)致餐后血糖降低��,我們?cè)诎唏R魚(yú)仔魚(yú)中進(jìn)行了 RNA 測(cè)序分析��。Kyoto-encyclopedia基因和KEGG通路分析揭示了幾種受 aldh2.1 敲除顯著調(diào)控的通路,包括但不限于上調(diào)的應(yīng)激信號(hào)和下調(diào)的能量代謝���。細(xì)胞凋亡、鐵死亡和細(xì)胞衰老的標(biāo)準(zhǔn)化富集評(píng)分 (NES) 介于 1.5 和 1.7 之間��。更重要的是����,發(fā)現(xiàn)了 NES 為 1.46 的 VEGF 通路成分和 NES 為 1.58 的絲裂原活化蛋白激酶 (MAPK) 的過(guò)表達(dá)��,為 aldh2.1-/- 視網(wǎng)膜血管中的機(jī)制提供了第一個(gè)線索。在另一個(gè)位點(diǎn)����,下調(diào)的能量代謝途徑包括脂肪酸降解和氨基酸代謝����,但也發(fā)現(xiàn)了丙酮酸代謝和糖酵解/糖異生��。糖酵解/糖異生的基因集富集分析 (GSEA) 顯示丙酮酸代謝的 NES 分別為 -1.82 和 -2.02,表明 aldh2.1 確實(shí)參與了葡萄糖代謝。
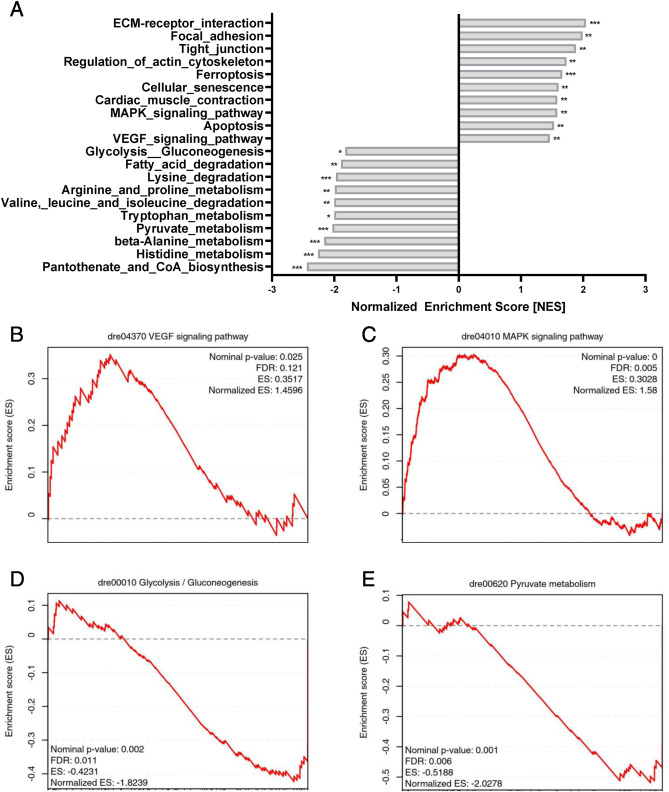
圖 5. aldh2.1-/- 突變體表現(xiàn)出加強(qiáng)的應(yīng)激信號(hào)傳導(dǎo)以及糖酵解和糖異生的損害��。
aldh2.1-/- 突變體中葡萄糖-6-磷酸酶表達(dá)的抑制和 JNK 和 p38 MAPK 表達(dá)的改變:基于 RNA-seq 數(shù)據(jù)����,我們探索了選定基因在已識(shí)別途徑中的表達(dá)���,可以解釋 aldh2.1-/- 斑馬魚(yú)與視網(wǎng)膜血管生成增加和葡萄糖穩(wěn)態(tài)受損相關(guān)的潛在機(jī)制。血管生成標(biāo)志物的基因表達(dá)���,如 fgfr2���、vegfr2 和 notch1a 在 aldh2.1-/- 和 aldh2.1+/+ 仔魚(yú)之間沒(méi)有變化�。因此����,焦點(diǎn)隨后轉(zhuǎn)移到 MAPK 家族的成員上����,因?yàn)?ERK1、JNK 和 p38 MAPK 都以其改變內(nèi)皮細(xì)胞活化和血管生成的能力而聞名。mapk3和mapk7(分別稱為ERK1和ERK5)沒(méi)有改變�。然而,mapk8b(也稱為JNK1)的表達(dá)增加了兩倍����,而mapk11-14(稱為p38 MAPK)的表達(dá)減少了兩倍。同時(shí),通過(guò)選定的基因調(diào)節(jié)糖酵解�����、糖異生和葡萄糖內(nèi)化��,我們探討了成魚(yú) aldh2.1-/- 突變體餐后血糖濃度降低的原因��。RT-qPCR檢測(cè)到葡萄糖-6-磷酸酶表達(dá)降低了四倍,在糖異生過(guò)程中��,葡萄糖-6-磷酸轉(zhuǎn)化為葡萄糖。一份研究確實(shí)在幾年前假設(shè) AA 抑制了葡萄糖 6-磷酸酶的表達(dá),我們的數(shù)據(jù)現(xiàn)在首次在體內(nèi)顯示了這種調(diào)節(jié)����,因?yàn)?aldh2.1-/- 突變體中的 AA 高度增加�。相應(yīng)地,在 aldh2.1-/- 突變體中觀察到葡萄糖激酶 (gck) 減少了三倍,該酶通過(guò)葡萄糖磷酸化為葡萄糖 6-磷酸來(lái)介導(dǎo)糖酵解的第一步�����。此外�����,糖異生的關(guān)鍵調(diào)節(jié)因子磷酸烯醇丙酮酸脫羧酶(pepck)表達(dá)下調(diào)1.7倍���,受底物葡萄糖-6-磷酸刺激的葡萄糖-6-磷酸脫氫酶(g6pd)也下調(diào)1.3倍。最后,aldh2.1-/- 突變仔魚(yú)中的胰島素表達(dá)和 pdx 1 表達(dá)顯著下調(diào)�����?�?傊x定的單基因表達(dá)數(shù)據(jù)證實(shí)了 RNA-seq 數(shù)據(jù),它們可以通過(guò)斑馬魚(yú)仔魚(yú)中改變的 JNK 和 p38 MAPK 信號(hào)傳導(dǎo)來(lái)解釋 aldh2.1-/- 突變體視網(wǎng)膜血管中血管生成的增加�。該數(shù)據(jù)還表明了一種新的葡萄糖代謝受損機(jī)制���,其中抑制葡萄糖激酶和葡萄糖-6-磷酸酶表達(dá)的內(nèi)源性 AA 的增加會(huì)導(dǎo)致低血糖癥。
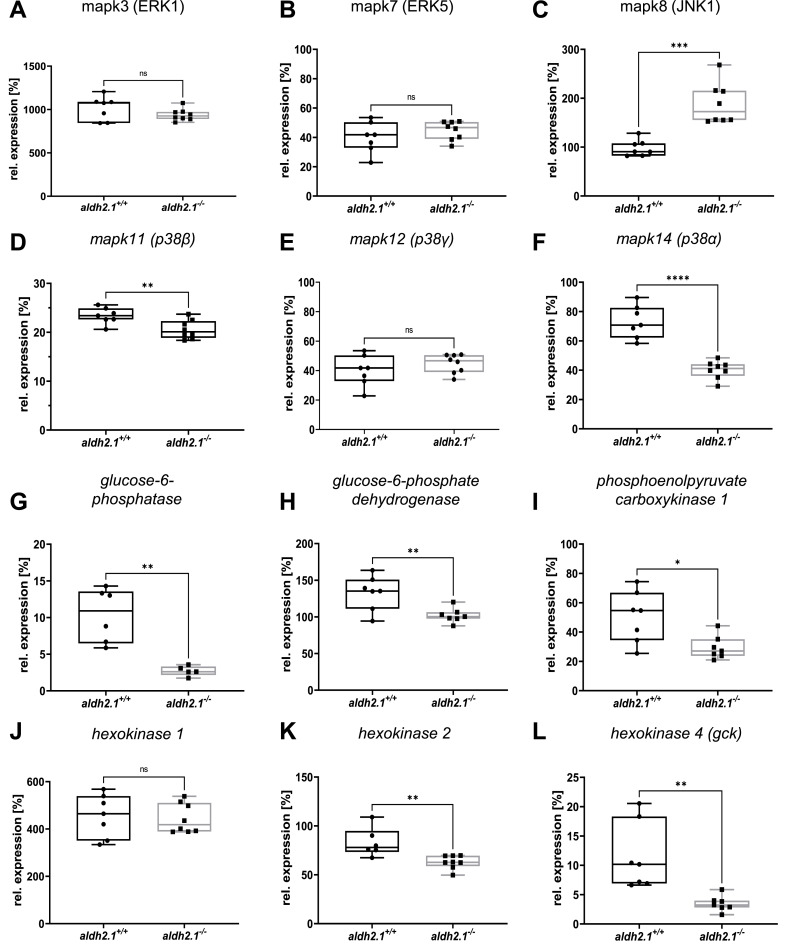
圖 6. aldh2.1-/- 突變體中葡萄糖-6-磷酸酶/葡萄糖激酶表達(dá)的抑制和 JNK 和 p38 MAPK 表達(dá)的改變��。
外源性AA引起玻璃體血管系統(tǒng)的血管生成性改變��、糖代謝受損和MAPK信號(hào)改變:對(duì) aldh2.1-/- 突變體的分析確定了視網(wǎng)膜血管中的微血管并發(fā)癥,但尚不清楚這些改變是由 aldh2.1-/- 突變體直接誘導(dǎo)還是由內(nèi)源性 AA 增加并隨后損害葡萄糖代謝和應(yīng)激信號(hào)傳導(dǎo)間接誘導(dǎo)����。為了解決這個(gè)問(wèn)題����,我們用AA孵育野生型斑馬魚(yú)仔魚(yú)����,并重復(fù)之前對(duì)視網(wǎng)膜玻璃體結(jié)構(gòu)和RT-qPCR的分析,以確定選定的基因表達(dá)。事先對(duì)斑馬魚(yú)仔魚(yú)中的AA進(jìn)行了毒性測(cè)試�����,結(jié)果顯示其 AA耐受性高達(dá)500?μM���。對(duì) 120 hpf 斑馬魚(yú)與 50μMA AA 孵育的玻璃體血管分析表明����,外源性 AA 可以模擬 aldh2.1-/- 突變體中所見(jiàn)的微血管并發(fā)癥��,但不會(huì)放大它���。在有和沒(méi)有 AA 孵育的 aldh2.1+/+ 斑馬魚(yú)仔魚(yú)之間�����,分支點(diǎn)增加了 1.36 倍����。沒(méi)有外源乙醛的 aldh2.1+/+ 和有和沒(méi)有 AA 孵育的 aldh2.1-/- 斑馬魚(yú)仔魚(yú)之間的分支點(diǎn)也增加了 1.3-1.5 倍�����。除視網(wǎng)膜分析外�����,還對(duì)AA孵化的野生型斑馬魚(yú)仔魚(yú)進(jìn)行了RT-qPCR����。結(jié)果顯示 JNK1 表達(dá)上調(diào) 1.53 倍����,p38α MAPK 表達(dá)下調(diào) 1.77 倍����。 此外�,ERK1 的表達(dá)也略有增加。有趣的是�,在 AA 治療后���,g6pc 和 gck 表達(dá)下降了 2.18 和 1.84 倍����,而 pepck 沒(méi)有顯著下降�����?��?傊瑪?shù)據(jù)表明 aldh2.1-/- 突變體中葡萄糖代謝受損是由 AA 引起的�����。 由于 aldh2.1 的丟失�����,AA 未被解毒并在體內(nèi)積累���,并下調(diào) gck 和 g6pc。此外�����,AA 也被確定為 aldh2.1-/- 視網(wǎng)膜脈管系統(tǒng)中血管生成增加的驅(qū)動(dòng)因素�����。

圖 7. 外源性 AA 引起玻璃體脈管系統(tǒng)的血管生成改變�、葡萄糖代謝受損和 MAPK 信號(hào)改變�。
p38 MAPK的抑制在aldh2.1+/+ 斑馬魚(yú)仔魚(yú)的玻璃體血管系統(tǒng)中引起類似但不完全相同的血管生成改變:用選擇性p38 MAPK抑制劑4-(4-氟苯基)-2-(4-甲基亞磺酰基苯基)-5-(4-吡啶基)1H咪唑孵育斑馬魚(yú)仔魚(yú)來(lái)證明是否p38 MAPK 是 AA 水平增加��、aldh2.1 敲除和微血管并發(fā)癥之間的聯(lián)系環(huán)節(jié)����。用 p38 MAPK 抑制劑孵育 aldh2.1+/+ 和 aldh2.1-/- 斑馬魚(yú)仔魚(yú)來(lái)對(duì)透明血管進(jìn)行分析,結(jié)果顯示出與先前對(duì) aldh2.1-/- 突變體和用 AA 處理的仔魚(yú)相似的結(jié)果。aldh2.1+/+ 斑馬魚(yú)玻璃體血管在用 p38 MAPK 抑制劑處理后分支點(diǎn)增加了 1.34 倍�。 aldh2.1-/- 突變體的處理不能進(jìn)一步增加分支點(diǎn)����。這與之前的 RT-qPCR 結(jié)果一致��,因?yàn)?p38 MAPK mRNA 表達(dá)在 aldh2.1-/- 突變體中顯著下調(diào)。與 aldh2.1+/+ 仔魚(yú)相比,與 p38 MAPK 抑制劑孵育僅導(dǎo)致 aldh2.1-/- 敲除仔魚(yú)中玻璃體血管分支點(diǎn)的非顯著增加���,因此表明 p38 MAPK 不是這種表型的唯一驅(qū)動(dòng)力���。
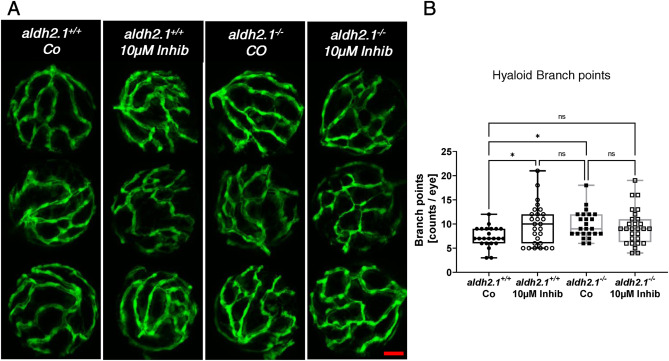
圖 8. p38 MAPK 的抑制導(dǎo)致 aldh2.1+/+ 仔魚(yú)玻璃體血管系統(tǒng)的血管生成改變��。
討論:在這項(xiàng)研究中,我們建立了一個(gè) aldh2.1-/- 突變斑馬魚(yú)模型來(lái)研究 RCS 解毒和體內(nèi)積累內(nèi)源性 AA 的后果����。AA增加導(dǎo)致視網(wǎng)膜血管微血管損傷����,并通過(guò)阻斷gck和g6pc基因表達(dá)導(dǎo)致餐后血糖水平降低�。因此,該研究確定了RCS在不涉及高血糖的情況下?lián)p害糖代謝和誘導(dǎo)血管生成的新機(jī)制。RCS是在新陳代謝過(guò)程中自發(fā)形成的��,被認(rèn)為是危險(xiǎn)分子����,因?yàn)樗鼈兛梢孕揎椇蛽p害DNA、蛋白質(zhì)和脂質(zhì)的功能。近年來(lái)����,研究表明,特定 RCS 解毒酶的喪失首先導(dǎo)致 RCS 增加��,隨后改變了葡萄糖代謝并介導(dǎo)了糖尿病器官并發(fā)癥的發(fā)展。具體而言��,斑馬魚(yú)中 glo1 的丟失增加了 MG 濃度,并伴有葡萄糖耐量受損�����。在 aldh3a1 敲除斑馬魚(yú)突變體中�,4-HNE 濃度的增加破壞了胰腺的形成�,抑制了胰島素的表達(dá)����,從而促進(jìn)了高血糖和視網(wǎng)膜血管舒張表型��。此外����,akr1a1a 斑馬魚(yú)突變體中 ACR 的增加導(dǎo)致胰島素抵抗��,從而導(dǎo)致糖尿病視網(wǎng)膜病變和糖尿病腎病���。本研究中表明 aldh2.1-/- 突變斑馬魚(yú)中 AA 濃度的增加會(huì)損害葡萄糖代謝����,導(dǎo)致血糖水平降低并誘導(dǎo)血管生成的激活。已經(jīng)確定了個(gè)體 RCS 的特定特征及其相應(yīng)的解毒酶系統(tǒng)。除 AA 外,所有累積的 RCS 都會(huì)引起高血糖����,從而導(dǎo)致糖尿病視網(wǎng)膜病變或糖尿病腎病的特征�����。 AA 還誘導(dǎo)視網(wǎng)膜微血管改變����,但與高血糖無(wú)關(guān)��。隨后進(jìn)一步的實(shí)驗(yàn)發(fā)現(xiàn),AA 通過(guò)阻斷糖酵解和糖異生的關(guān)鍵調(diào)節(jié)酶(即 gck 和 g6pc)的表達(dá)導(dǎo)致葡萄糖敏感性和葡萄糖動(dòng)員受損����,最終導(dǎo)致 aldh2.1-/- 突變體中的餐后血糖濃度降低���。aldh2.1 的人類同源物 aldh2,因其在乙醇解毒中的重要性而被廣泛研究。 然而�����,對(duì)酒精介導(dǎo)的應(yīng)激并發(fā)癥的研究主要包括心臟病、癌癥和肝病的研究卻很少。在糖尿病患者中進(jìn)行的觀察已經(jīng)將飲酒與低血糖發(fā)作聯(lián)系起來(lái)�,但關(guān)于酒精如何抑制糖酵解和糖異生的潛在機(jī)制尚未探索��。導(dǎo)致這種現(xiàn)象的重要上游因素不是乙醇�����,而是AA。AA阻斷g6pc的表達(dá)并隨后抑制葡萄糖-6-磷酸形成葡萄糖并將其釋放到血液中���,這一發(fā)現(xiàn)在幾年前就已被假設(shè)���。此外�,AA 還通過(guò)阻斷 gck 的表達(dá)來(lái)誘導(dǎo)葡萄糖敏感性降低。 后者本身已知會(huì)導(dǎo)致糖尿病或低血糖癥����。本研究表明 aldh2 和 AA 在調(diào)節(jié)葡萄糖代謝中具有高度相關(guān)性。該研究還表明,aldh2.1-/- 突變體中內(nèi)源性 AA 的增加導(dǎo)致視網(wǎng)膜病變而非高血糖�����。 已知 Aldh2 在保護(hù)線粒體方面具有重要功能����,特別是 aldh2 的缺失會(huì)通過(guò) CYP2E1、Nrf2 和 TNF-α 以及隨后的 RCS 觸發(fā) ROS 形成的增加�����。此外���,改變的 Aldh2 和相應(yīng)的 AA 與心血管疾病相關(guān)���,包括但不限于缺血和心肌功能障礙�。然而�,尚未描述沒(méi)有高血糖癥的 aldh2.1-/- 斑馬魚(yú)中發(fā)生視網(wǎng)膜病變的機(jī)制��。試驗(yàn)顯示 aldh2.1-/- 斑馬魚(yú)中 JNK 和 p38 MAPK 表達(dá)失衡。眾所周知��,這兩種應(yīng)激激活蛋白激酶在血管生成中具有多種功能����。 一方面��,它們通過(guò)激活內(nèi)皮細(xì)胞充當(dāng)血管生成的分子開(kāi)關(guān)�; 此外���,它們可以誘導(dǎo)內(nèi)皮細(xì)胞層的高滲透性。此外�,血管壁細(xì)胞脫落長(zhǎng)期以來(lái)一直被認(rèn)為是微血管穩(wěn)態(tài)的關(guān)鍵因素���,最近的研究表明,壁細(xì)胞的丟失增加了視網(wǎng)膜脈管系統(tǒng)對(duì) VEGF 信號(hào)傳導(dǎo)和視網(wǎng)膜血管生成的敏感性。因此,aldh2.1-/- 幼蟲(chóng)和成蟲(chóng)中視網(wǎng)膜病變的發(fā)作是由 MAPK 家族成員的調(diào)節(jié)改變和通過(guò)反應(yīng)性代謝物 AA 減少血管壁細(xì)胞覆蓋率驅(qū)動(dòng)的���,與高血糖無(wú)關(guān)�����。這項(xiàng)研究和之前的數(shù)據(jù)表明,內(nèi)部產(chǎn)生的 RCS 在新陳代謝中會(huì)導(dǎo)致糖代謝受損��、糖尿病和糖尿病相關(guān)的器官并發(fā)癥�。數(shù)據(jù)表明,只要 RCS 相應(yīng)的酶系統(tǒng)功能正常,就可以預(yù)防糖尿病和微血管器官的改變����。迫切需要確定解毒酶系統(tǒng)的上游因素����,了解它們的激活機(jī)制以及它們?cè)诓煌膊l件下是如何改變的��。必須確定RCS及其相應(yīng)酶系統(tǒng)在糖尿病和其他疾病中的相互作用和串?dāng)_。最后��,更需解決一個(gè)問(wèn)題�,即患病斑馬魚(yú)中已識(shí)別的RCS改變特征是否也存在于人類疾病中。必須研究RCS是否可以用作不同糖尿病亞型的生物標(biāo)記物,以及是否會(huì)在人類中引發(fā)與斑馬魚(yú)相同的糖尿病并發(fā)癥����。
原文出自:Accumulation of acetaldehyde in aldh2.1?/? zebrafish causes increased retinal angiogenesis and impaired glucose metabolism - ScienceDirect




 17312606166
17312606166