脊椎動物造血發(fā)育過程分為初級造血和次級造血兩個階段�����,初級造血主要產(chǎn)生初級髓系和紅系細(xì)胞,次級造血主要產(chǎn)生造血干祖細(xì)胞�。其中,初級血細(xì)胞作為重要的微環(huán)境細(xì)胞組分,在多個層面參與造血干祖細(xì)胞發(fā)育的調(diào)控[1]��。比如����,初級髓系細(xì)胞能通過分泌炎性信號[2]���、降解胞外基質(zhì)[3]等促進(jìn)造血干祖細(xì)胞產(chǎn)生�����。但是�,初級紅細(xì)胞在生理或病理狀態(tài)下對造血干祖細(xì)胞產(chǎn)生的影響尚不明確�����。哺乳動物中���,初級紅細(xì)胞缺陷突變體由于胚胎缺氧而致死�����,胚胎不能存活至次級造血階段[4]����。而斑馬魚胚胎在體外發(fā)育�,發(fā)育早期可以通過滲透作用吸收氧氣�,因此斑馬魚初級紅細(xì)胞缺陷的胚胎可以存活至次級造血階段[5, 6]��。此外,紅細(xì)胞發(fā)生和鐵代謝密切相關(guān)���。近年研究表明�����,骨髓微環(huán)境中鐵的濃度能影響造血干細(xì)胞命運(yùn)決定[7]����,特定病理狀態(tài)下的造血干細(xì)胞也對鐵死亡敏感[8]�。然而����,胚胎發(fā)育過程中���,鐵穩(wěn)態(tài)是否影響造血干祖細(xì)胞的產(chǎn)生也仍不清楚����。
近期,中國科學(xué)院動物研究所劉峰研究組在Development雜志上發(fā)表了題為“Heme-deficient primitive red blood cells induce HSPC ferroptosis by altering iron homeostasis during zebrafish embryogenesis”的研究論文�。在這篇文章中,研究人員揭示了血紅素缺陷初級紅細(xì)胞導(dǎo)致造血干祖細(xì)胞鐵死亡的調(diào)控機(jī)制����。

首先,研究人員使用反義寡核苷酸(Morpholino)基因敲降技術(shù)構(gòu)建了斑馬魚初級紅細(xì)胞發(fā)育缺陷模型��,篩選后發(fā)現(xiàn)只有在敲低紅細(xì)胞血紅素合成限速酶編碼基因alas2和alad的斑馬魚胚胎中出現(xiàn)造血干祖細(xì)胞缺陷表型���。隨后在功能缺失突變體中證實(shí)了造血干祖細(xì)胞缺陷的表型��。進(jìn)一步研究發(fā)現(xiàn)�,alas2和alad缺陷的胚胎中�����,紅細(xì)胞數(shù)目不受影響��,但血紅蛋白缺失,機(jī)體鐵代謝異常�,紅細(xì)胞出現(xiàn)鐵聚集的表型�。
隨后,研究人員通過檢測血清鐵含量�,證實(shí)了血紅素缺陷的異常紅細(xì)胞會導(dǎo)致血液鐵過載����。分選紅細(xì)胞進(jìn)行轉(zhuǎn)錄組測序分析,以及抑制劑處理實(shí)驗(yàn)進(jìn)一步證實(shí)了異常初級紅細(xì)胞通過鐵轉(zhuǎn)運(yùn)蛋白(Slc40a1)介導(dǎo)鐵的外排��,導(dǎo)致血液鐵過載����。而血液鐵過載和造血干祖細(xì)胞缺陷密切相關(guān)����。通過使用gata1 morpholino注射的方式����,阻礙突變體中初級紅細(xì)胞的產(chǎn)生�,不僅能恢復(fù)血液鐵水平�,還能回救造血干祖細(xì)胞缺陷表型�。進(jìn)一步證實(shí)了異常初級紅細(xì)胞引起的血液鐵過載是導(dǎo)致造血干祖細(xì)胞缺陷的重要因素��。
上述結(jié)果提示,造血干祖細(xì)胞的數(shù)目減少可能與鐵死亡相關(guān)�。研究人員通過掃描電鏡成像��,發(fā)現(xiàn)alas2和alad突變體中����,造血干祖細(xì)胞呈現(xiàn)出明顯的鐵死亡特征改變���,包括線粒體形態(tài)變化�、細(xì)胞質(zhì)膜的破壞等(圖1)��。進(jìn)一步檢測發(fā)現(xiàn)alas2和alad突變體中造血干祖細(xì)胞促鐵死亡相關(guān)的大分子氧化酶編碼基因表達(dá)量升高,抗鐵死亡相關(guān)蛋白(包括Fth1、Gpx4和Slc7a11)含量減少���。除此之外,研究人員使用鐵螯合劑(DFO)以及鐵死亡抑制劑(Ferrostatin-1)處理都能有效回救造血干祖細(xì)胞缺陷的表型���。以上結(jié)果表明,alas2和alad突變體中造血干祖細(xì)胞發(fā)生了鐵死亡��。
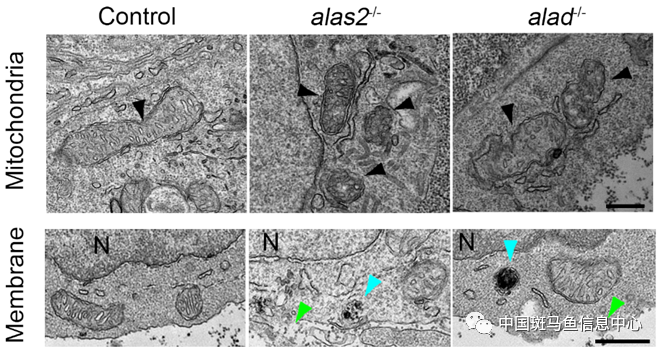
圖1 alas2和alad突變體中造血干祖細(xì)胞出現(xiàn)明顯鐵死亡特征表型
此外�����,進(jìn)一步功能實(shí)驗(yàn)證實(shí)了造血干祖細(xì)胞通過轉(zhuǎn)鐵蛋白受體(Tfr1b)響應(yīng)鐵過載環(huán)境���,導(dǎo)致過量鐵的攝入��。氧化應(yīng)激相關(guān)檢測表明����,過量鐵引起造血干祖細(xì)胞活性氧水平升高�,細(xì)胞氧化應(yīng)激壓力升高。結(jié)合脂質(zhì)氧化組學(xué)檢測���,證實(shí)了花生四烯酸類脂質(zhì)過氧化是導(dǎo)致造血干祖細(xì)胞鐵死亡的直接原因�。最后,研究人員通過造血干祖細(xì)胞移植實(shí)驗(yàn)����,初步明確了受鐵死亡影響的主要為紅系傾向性的造血干祖細(xì)胞。
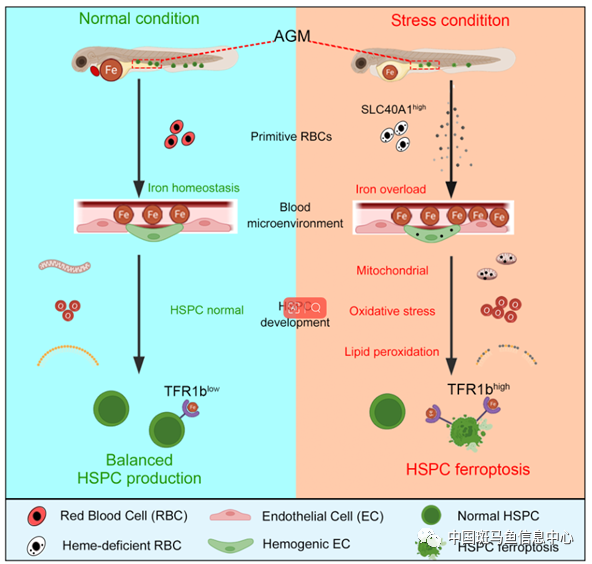
圖2 工作模式圖
綜上所述�,這項(xiàng)研究發(fā)現(xiàn)�,在alas2和alad突變體中,血紅素缺陷的初級紅細(xì)胞導(dǎo)致造血干祖細(xì)胞鐵死亡��。機(jī)制上��,異常紅細(xì)胞通過Slc40a1導(dǎo)致血液鐵過載,而造血干祖細(xì)胞Tfr1b介導(dǎo)了過量鐵的攝入����,進(jìn)而通過鐵-活性氧-脂質(zhì)氧化軸介導(dǎo)了造血干祖細(xì)胞的鐵死亡(圖2)。該研究揭示了紅細(xì)胞鐵穩(wěn)態(tài)在造血干祖細(xì)胞發(fā)育過程中的重要作用�,為鐵代謝異常導(dǎo)致的惡性血液疾病提供了潛在的臨床指導(dǎo)����。
參考文獻(xiàn):
1. Vink, C.S., S.A. Mariani, and E. Dzierzak, Embryonic Origins of the Hematopoietic System: Hierarchies and Heterogeneity.Hemasphere, 2022. 6(6): p. e737.
2. Espin-Palazon, R., et al., Proinflammatory signaling regulates hematopoietic stem cell emergence. Cell, 2014. 159(5): p. 1070-1085.
3. Travnickova, J., et al., Primitive macrophages control HSPC mobilization and definitive haematopoiesis. Nat Commun, 2015. 6: p. 6227.
4. Baron, M.H., J. Isern, and S.T. Fraser, The embryonic origins of erythropoiesis in mammals. Blood, 2012. 119(21): p. 4828-37.
5. Lyons, S.E., et al., A nonsense mutation in zebrafish gata1 causes the bloodless phenotype in vlad tepes. Proc Natl Acad Sci U S A, 2002. 99(8): p. 5454-9.
6. Ransom, D.G., et al., The zebrafish moonshine gene encodes transcriptional intermediary factor 1gamma, an essential regulator of hematopoiesis. PLoS Biol, 2004. 2(8): p. E237.
7. Zhang, D., et al., The microbiota regulates hematopoietic stem cell fate decisions by controlling iron availability in bone marrow. Cell Stem Cell, 2022. 29(2): p. 232-247 e7.
8. Zhao, J., et al., Human hematopoietic stem cell vulnerability to ferroptosis. Cell, 2023. 186(4): p. 732-747 e16.




 17312606166
17312606166